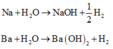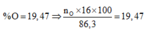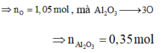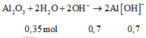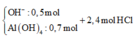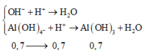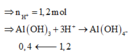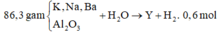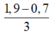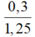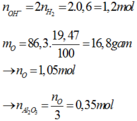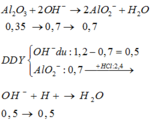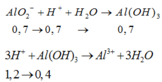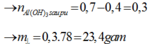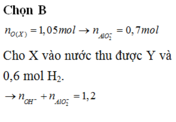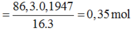Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước thu được dung dịch Y và 13,44 lít H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y thu được m gam kết tủa. Lấy m gam kết tủa đó cho tan hết trong V mL dung dịch KOH 1,25M. Giá trị tối thiểu của V là
A. 240.
B. 360.
C. 320.
D. 220.